天津国晟中源科技有限责任公司
6 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
技术资料/正文
胰腺炎动物模型
531 人阅读发布时间:2024-04-29 14:24
AP动物模型通常不能自发产生,需要相关药物进行诱导。常见的药物诱导AP动物模型如下:
01 逆行胰胆管注射法
逆行胰胆管注射法是目前公认的急性坏死胰腺炎的经典模型,此模型通常应用牛磺胆酸钠( sodium taurocholate,ST)诱导产生AP模型。牛磺胆酸钠是体内2种胆汁酸的主要成分之一,低浓度胆汁酸保护腺泡细胞,高浓度胆汁酸则损害腺泡细胞。
胆胰管逆行ST注射法主要模拟胆总管下段梗阻时,胆汁反流引起AP,与胆源性胰腺炎的发病过程类似。(主要模拟的是胆源性AP发病机制,因胆源性为AP最常见诱因,故此方法应用较广。)
这种模型多伴有多器官功能衰竭,适用于研究AP的局部和全身并发症,用于临床胆汁反流性胰腺炎的发病机制及药物治疗疗效的研究,可为研究SAP的靶向治疗提供工具。
研究显示,ST是建立ABP动物模型最标准的化合物,注射浓度一般为3.0%~5.0%。
造模方法
动物:6-8周龄SD大鼠,约200-220 g,雄性
制备环境:屏障环境,大鼠进去动物房后饲养一周让其适应环境后再开始实验。
制备周期:1周
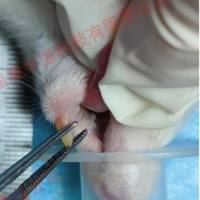
操作:SD大鼠麻醉后,备皮,正中切口开腹,轻拉出十二指肠,顺胆胰管寻找十二指肠开口,使用穿刺针在近十二指肠开口端逆行刺入胰胆管,用动脉夹夹住胆管入肝处,以0.1mL/min速度向胰管内匀速注射3%牛磺胆酸钠溶液(按0.1mL/100g剂量),注射完毕后留针8-10min,肉眼观察胰腺颜色变暗红,拔出穿刺针,松开血管夹,并缝合穿刺的十二指肠壁以免肠液漏至腹腔,确认腹腔无活动性出血后层层缝皮即可。
术后护理:术后大鼠自由饮水,但禁食。
注:不同浓度的牛磺胆酸钠造的急性胰腺炎程度不一样。小鼠胆胰管直径较小且被胰腺组织包绕,不能作为首选动物;大鼠胆胰管直径大于小鼠,可作为首选。优点:病因、致病机制及病变与临床急性出血坏死型胰腺炎(AHNP)相似,成功率高,重复性好,可比性高。
缺点:对操作者的技术熟练度要求较高(寻找胆胰管开口处进行穿刺并注射ST仍有难度),操作费时,死亡率较高,易造成胆漏,且无法评估注射液引起胰胆管压力变化对AP的影响。
02 雨蛙素(caerulein,CAE)注射法
正常胰腺的代谢与促分泌素的生理浓度相关,AP是由于促胰液素大量分泌,导致胰腺消化酶分泌过多,引起胰腺自身消化。
促分泌素模型最常使用的是雨蛙素(CAE),它是一种在功能和组成上均类似于人 胆囊收缩素的十肽类物质,可刺激胃肠激素分泌,具有较强的胆囊收缩和刺激胰酶分泌的作用。一些研究表明,CAE能刺激胰腺腺泡,导致胰蛋白酶原激 活成胰蛋白酶,引起胰腺腺泡自溶。
雨蛙素的配制:取1 mg的雨蛙素溶于1 mL生理盐水中,配制成1 mg/mL母液,冻存。使用前解冻,用生理盐水稀释成5 μg/mL的工作液。造模方法:将溶解好的浓度为5μg/ml雨蛙素生理盐水溶液按10ml/kg/次腹腔注射给药,每隔1小时进行一次给药,共计7次。
优点:创伤小,方法操作简便,容易复制,重复性好,是较为理想稳定的动物模型。
缺点:病情相对较轻,仅能诱导水肿型AP动物模型,临床相关性有限。CAE体内代谢周期较短,需多次给药。
方法改进:将LPS(lipopolysaccharide,LPS)与雨蛙素结合构造SAP,实验方法主要为向小鼠腹腔注射雨蛙50μg/kg(连续6次,间隔1 h),最后一次注射后,同时腹腔注射LPS 10 mg/kg,病理切片发现明显的水肿出血,大量的炎症细胞浸润,提示符合重症AP的病理。
03 碱性氨基酸诱导AP动物模型——L-精氨酸(L-Arg)注射法
生理条件下,胰腺大量摄取氨基酸以合成胰酶,但高浓度氨基酸聚集会破坏胰腺外分泌腺,诱发AP。L-Arg(L-精氨酸)是应用较为广泛的用于诱导AP动物模型的碱性氨基酸。
L-Arg诱导AP动物模型,通常剂量为250-500mg/100g。L-Arg的作用呈剂量和时间依赖性,单次注射L-Arg 500mg/100g,70-80%胰腺腺泡细胞在3d内坏死,3次注射L-Arg 250mg/100g超过10d,近90%的腺泡被破坏。
造模方法:大鼠:1次腹腔内给药1g/kg;小鼠:腹腔注射8% L -Arg 4 g/kg,连续2次,间隔1h。
优点:操作简便,价廉,对机体损伤小,死亡率低,有良好的时间和剂量依赖性,所致胰腺炎与人胰腺炎相似,病变均匀。
缺点:个体差异极大,病理机制与临床相关性差。
04 无胆盐乙硫氨酸(choline deficient ethionine,CDE)喂养法
乙硫氨酸抑制甲硫氨酸代谢,降低细胞膜磷脂的合成效率,引起胰腺腺泡细胞损伤,导致腺泡细胞内消化酶激活,最终引起血清胰酶活性增高。胆碱缺乏可进一步加强乙硫氨酸对甲硫氨酸的拮抗作用,且雌激素在此过程中起重要的调节作用。
CDE食物可诱发小鼠出血坏死性胰腺炎和脂肪坏死,出现腹水、低血容量、酸中毒等症状,适用于不同病程的病理机制及评价不同治疗方法和药物的临床疗效研究。
造模方法:给4-6周体重10-14g的雌性小鼠喂食CDE饲料(包括蔗糖55%,猪油20%,大豆蛋白10%,各种维生素和无机盐,3%乙硫氨酸)。
优点:简便、损伤小,死亡率可通过调整喂养时间控制,病理生理和生化变化过程与人AP相似。
缺点:饲料成本高,模型死亡率与CDE摄入量相关。在实验动物的选择上具有局限性,幼小老鼠比成年老鼠的CDE灵敏度高,雌性老鼠比雄性老鼠易诱导AP,对实验动物的同质性要求严格。稳定性不好,耗时较长,有高血糖和低血钙等明显内分泌紊乱。
05 结扎法
有胰管结扎法和十二指肠结扎法等,结扎使胆胰管腔内压力增高,使胆汁反流入胰管,胆汁破坏胰管上皮的粘膜屏障,并被胰液的磷脂酶分解为可破坏细胞膜和导管的溶血卵磷脂,胰内蛋白酶被激活,导致胰腺组织的自我消化,造成胰腺水肿、出血和坏死。
优点:模型稳定可靠,无关干扰因素少,符合急性胆源性胰腺炎发病机制。避免了外源性药物的应用引起全身反应,避免了外源性药物对AP自然病程的影响。
缺点:操作复杂,模型重现性差、操作技术不成熟,易造成肠梗阻,甚至肠管缺血性坏死,胰腺坏死可逆性差,死亡率高。
06 电针刺激法
造模方法:大鼠麻醉后,切开腹腔,提起十二指肠,暴露胆胰管末端,将电针末端弯成钩状,在胆胰管末端用电针钩住,两侧电针相距约2mm、电压3V、频率20Hz,电针持续刺激胆管末端1h,直至胰管轻微肿胀及出血,依次关闭腹腔。
优点:电刺激法模拟临床上胆囊内微小结石通过十二指肠乳头部进入肠道,诱发AP的病理机制。病理生理更符合临床急性胆源性胰腺炎的发生过程,耗费低,重复性好,不受动物种类限制。
缺点:其操作步骤比较复杂,创伤大,动物死亡率高,目前较少使用。
另有高钙血症法、动脉注射微球法、免疫介导法等,为加强临床相关性,可联合2种或2种以上方法。