天津国晟中源科技有限责任公司
6 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
技术资料/正文
检测实验丨流式表面抗原鉴定实验步骤及注意事项
1577 人阅读发布时间:2024-07-16 15:36
流式表面抗原鉴定
流式细胞术(Flow Cytometry,简称FCM)借助流式细胞仪,能够详尽地检测并筛选单个微粒的多元属性。
该技术以其快速性、精确性和客观性著称,涵盖了从样品液流技术的精密控制,到细胞精确计数与高效分选的整个过程,再到计算机对数据的深度采集与智能分析,构建了一个全面的细胞分析平台。
一、检测原理:
FCM通过精密设计的液流技术,确保样本中的微粒以单列、高速且稳定的状态流经检测区域。在这一过程中,细胞或颗粒被逐一曝光于激光束下,其散射光与荧光特性被精确捕捉,这些特性往往反映了细胞的形态、内部结构、表面分子表达及功能状态等关键信息。
借助先进的细胞计数与分选技术,FCM能够实时、准确地统计细胞数量,并根据预设的参数标准,如荧光强度、细胞大小、复杂度等,对目标细胞群体进行精准识别与分离。这一过程不仅提高了实验效率,还确保了分选结果的纯度和回收率。
FCM配备的计算机数据处理与分析系统,能够自动收集、整合并深度分析检测过程中产生的大量数据,通过复杂算法处理,提取出有价值的信息,如细胞亚群分布、信号强度变化等,为科研人员提供直观、全面的实验结果。
二、材料与仪器:
实验试剂:
待检测样本、流式直标抗体、PBS、流式 stain buffer、EP 管、固定剂、红细胞裂解液(血液样本选用)
实验仪器:
NOVOCYTE2000流式细胞分析仪、离心机、冰箱、移液器、涡旋振荡器、显微镜
三、实验步骤:
一、细胞样本
1、细胞准备:
倒掉细胞培养液,用适量PBS洗涤细胞。用胰酶消化或枪吹打使细胞脱落,1000 rpm离心15分钟。弃上清,用1 ml流式stain buffer重悬细胞,转移至标好标签的EP管中。
2、离心与重悬:
300 g,4℃离心5分钟,弃上清。用100 μL stain buffer重悬细胞。
3、抗体孵育:
加入适量体积的细胞表面标记物偶联抗体或同型对照。4℃避光孵育30分钟以上。
4、清洗与破膜(如需):
加入1 ml stain buffer清洗细胞,300 g,4℃离心5分钟,弃上清。如需破膜,则加入100 μl固定剂,室温避光孵育15分钟。用1 ml stain buffer洗涤一次,300 g,4℃离心5分钟,弃上清。加入100 μl破膜剂和适量体积的胞内抗体或同型对照,4℃避光孵育20~30分钟。再次用1 ml stain buffer清洗细胞,离心弃上清。
5、分析或保存:
用200 μL stain buffer重悬细胞,及时上机分析。
或用200 μL 4%甲醛固定,2~8℃避光保存,并在24小时内分析。
二、组织样本
1、组织处理:
取适量新鲜组织于EP管中,加入1 ml PBS。剪碎组织,用匀浆机匀至单细胞悬液,过滤器去除残渣。
2、离心与重悬:
300 g,4℃离心5分钟,弃上清。用100 μL stain buffer重悬细胞。
3、抗体孵育:
加入适量体积的细胞表面标记物偶联抗体或同型对照。4℃避光孵育20~30分钟。后续步骤(同细胞流式中的4和5步骤)。
三、全血样本
1、抗体孵育:
取100 μl肝素抗凝的人外周血,加入适量流式抗体,混匀。4℃避光孵育20~30分钟。
2、红细胞裂解:
加入1.5×红细胞裂解液2 ml,混匀,室温避光孵育10~15分钟至液体澄清透明。
3、离心与清洗:
1000 rpm离心5分钟,弃上清。加入1 ml stain buffer混匀,300 g,4℃离心5分钟,弃上清。
4、分析或保存:
用200 μL stain buffer重悬细胞,及时上机分析。或用200 μL 4%甲醛固定,2~8℃避光保存,并在24小时内分析。
※实验结果示例:
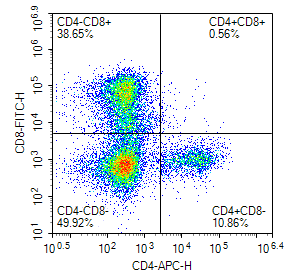
细胞及组织抗体多标染色实例
四、注意事项
1、流式细胞术一般用于活细胞检测,通常需要当天完成上机前的所有实验,如果当天来不及处理,可以用多聚甲醛固定液固定,然后放置 4° 冰箱隔天进行上机检测。
2、流式上机前一般需要制备单染管,尤其是进行多重标记,可以进行荧光补偿调节。