天津国晟中源科技有限责任公司
6 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
技术资料/正文
动物实验丨实验动物的灌注固定技巧
2045 人阅读发布时间:2024-03-20 15:28
实验动物的灌注固定技巧
灌注固定在神经系统中的应用尤为突出,而对其他组织的作用相对有限。由于其能够有效地防止变性,它对神经系统的保护作用非常显著。
一、小鼠灌注:
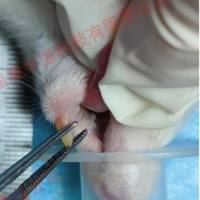
在灌流固定小鼠的过程中,通常使用4号半的输液器针头。当插入针头后,可以观察到肺部明显充气胀大并变白。针头需要从心轴方向进入,并刺入心尖3~4毫米左右。
开始灌流后,需要剪破右心耳,首先灌入约40毫升的生理盐水,然后再灌入约20毫升的多聚甲醛。这样,整个灌流固定的过程就完成了。
二、大鼠灌注:
对于大鼠的灌注固定,首先需要按其体重使用麻醉剂进行腹腔注射麻醉。然后开胸暴露心脏,向左心室内注射1%肝素钠0.2毫升,之后经左心室行主动脉插管。使用血管钳固定后,剪开右心耳,先用生理盐水150毫升快速冲洗血管,然后用4%多聚甲醛的0.01摩尔/升磷酸盐缓冲液(pH7.40)250毫升进行灌注固定。灌注速度先快后慢,总时间为50分钟。之后取材,并置入4%多聚甲醛固定液中保存。
当多聚甲醛进入大鼠体内时,可能会引起四肢和尾巴的抽搐,最终肝脏发白并伴有内脏鼓起,表示灌注已经完成。
三、脑组织免疫组化实验:
(一)、灌注固定用的针头,一般都用注射针头。灌注大鼠一般可用10到12号针头,小鼠可用 6、7 号针头,但很重要的一点是要把针头的尖端磨钝而不是用锐利的针头。
(二)、关于穿刺:灌注大鼠时要把穿刺针的尖端插入到升主动脉内,但不宜进入升主动脉过长,在动脉内见到针头或插入约1mm左右即可;灌注小鼠时只要把针头插入左心室内即可,不必要插入到升主动脉内。
操作的要点是:
第一,操作要迅速,剪开膈肌后,迅速沿腋前线剪开胸壁,并把胸前壁往上翻,暴露心脏;第二,一定要在明视野下操作,要剪开心包壁层的前壁,暴露升主动脉和肺动脉干的根部,确保穿剌针能进入升主动脉;
第三,穿刺之前要用适当大小的血管钳夹住心室以固定心脏,但不要夹得过紧,要让心腔内留有一定的间隙,然后在心尖处轻轻旋转针头插入穿刺针。也可以用小剪刀在心尖处先剪开一个小口再插入穿刺针;
第四,穿刺方向要正确,从心尖部开始,从左下方斜向右上方,若遇阻力要改变方向再试,不要用力蛮插。
(三)、剂量控制:灌注用生理盐水的量大鼠用50ml左右,小鼠用 10ml左右,一般以从右心耳流出的液体清亮为标准;4%多聚甲醛用量约相当于老鼠体重,如 300 克的老鼠用 300ml 左右。小鼠一般用 20-30ml。灌注速度先快后慢,可持续 1-2 个钟头,也可以稍快。取脑后置脑块于 4% 多聚甲醛内4度后固定 4-6 个钟头。
四、难点与关键点:
将灌注针准确插入主动脉是灌注固定的核心环节,同时也是最具挑战性的部分。
首先,必须精确定位主动脉的位置,这是该步骤的重中之重。为了实现这一目标,我们可以使用温生理盐水将胸腔内的血液冲洗干净,然后用眼科镊子轻轻夹住心脏外膜(夹持的面积越小越好),将心脏向左上方提起,这样可以使主动脉暴露出来,同时使得灌注针容易插入。
在插入灌注针时,动作必须缓慢,针尖方向要保持稳定,避免偏向右侧,以免误入右心房。如果感到有阻力,应该将针退后、调整方向重新进针,直到成功进入主动脉。灌注针进入主动脉后,可以在心脏的上方看到其位置。灌注针进入主动脉的长度最好为3~5毫米,然后用丝线扎紧以防止其移动。
切勿将灌注针放在左心室内。由于主动脉瓣的存在,灌注液很难进入主动脉而是沿着心室的切口流出导致灌注失败。当灌注针插入成功后需要用剪刀剪开右心耳而不是右心室以便于灌流液流出。在剪开心尖时位置要把握准确避免向右偏离导致灌注失败。
五、注意事项
1、针头的大小应与动物的种类相匹配,同时针头必须磨钝以确保安全和有效。
2、在使用灌注泵之前,务必检查其运作情况,确保管路中的气泡和空气被完全排出,以防止空气栓塞的发生。
3、在暴露胸腔的过程中,应首先清除升主动脉外面的脂肪组织和心外膜组织,以便于准确插入灌注针。
4、将针头经左心室插入升主动脉时(以颜色变白为指示),需用钳子固定住针头和升主动脉。
5、在开启灌注泵之前,要确保右心耳被解开,同时应避免揭开心脏的其他部位,因为这可能会导致灌注成功但造成灌注不均匀的情况发生,尤其是在处理肺水肿等特殊情况下更需注意。
6、在灌注过程中,应依次将4℃的生理盐水(以动物的肝脏发白为标准,实验室中大鼠大约需要250ml)和多聚甲醛(根据所取得的材料而定)注入体内。
7、为了最大程度地保存目的蛋白和酶的活性,整个灌注过程应将动物保持在冰上。